미국 규제당국에 희귀의약품 신청…”기술수출 타진”
항암 표적치료제 개발사 에이비온이 주력 파이프라인의 가치 높이기에 나선다. 미국 규제당국에 희귀의약품지정(ODD) 신청서를 제출했다.
앞선 임상 중간 결과서 긍정적인 데이터를 도출한 데 따라 기술수출 시 협상의 우위를 점하기 위한 전략으로 풀이된다.
◇c-Met 저해제 바바메킵, 美 FDA에 희귀의약품 신청
에이비온은 미국 식품의약국(FDA)에 ‘바바메킵'(코드명 ABN 401)의 ODD 신청서를 제출했다고 24일 밝혔다.
ODD 제도는 희귀질환의 약물 개발 및 허가를 원활하게 이뤄지도록 하기 위해 마련한 제도다. 미국 내 20만명 이하 질환이 대상이다. ODD로 지정된 의약품은 임상 개발비 세액 공제와 허가심사 수수료 감면 등을 받으며 미국 시장서 7년간 독점발매 기간 보장 등 혜택이 부여된다.
바바메킵은 비소세포폐암 치료제 후보물질로 간세포성장인자수용체(c-MET) 저해제 계열 표적항암제다. 폐암은 암 가운데 가장 발생률이 높은데 폐암 환자의 약 85%가 비소세포폐암에 해당한다. 비소세포폐암 환자 중 약 40%가 상피세포 성장인자 수용체(EGFR) 변이를 가진 환자다. 이들 환자에겐 1차 치료제인 EGFR 표적치료제를 사용한다.
문제는 내성이다. EGFR 표적치료제를 사용하는 대부분의 환자에서 내성이 발생한다. 기존에 쓰던 약을 더 이상 사용할 수 없다는 얘기다. EGFR 변이 내성 환자 중 절반 이상에서 c-MET 변이가 나타난다. 마땅한 치료제가 없어 미충족 의료수요가 높은 영역이다. c-MET 변이 항암 치료제 개발은 일라이릴리, 화이자, 존슨앤존슨 등 빅파마도 개발에 실패했을 정도로 개발이 어렵다고 알려져 있다.
◇2상 중간 결과로 ODD 허가 청신호…”가치 높여 L/O”
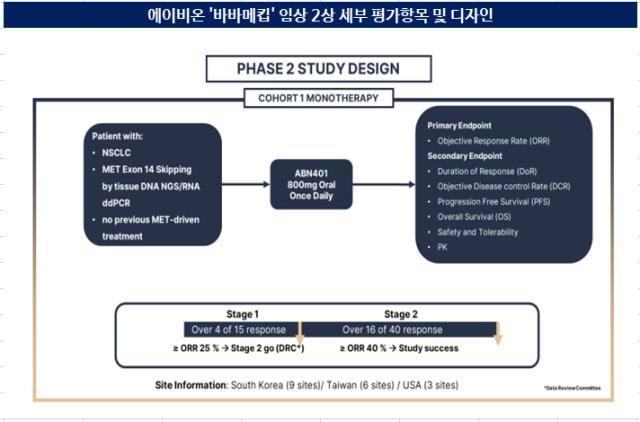
에이비온이 바바메킵의 ODD 절차를 추진하는 배경엔 작년 공개된 임상 2상 데이터가 있다. 지난해 10월 발표한 임상 2상 중간 결과 객관적반응률(ORR)이 53%로 나타났다. 최초 치료 환자군 대상으론 75%의 반응률을 보였다. 이는 경쟁 약인 노바티스의 ‘타브렉타’와 머크의 ‘텝메코’보다 우수한 수치다. 해당 데이터는 ODD 신청을 위한 핵심 근거로 활용할 수 있다.
중간 결과지만 긍정적인 결과를 도출한 만큼 무리 없이 ODD 지정이 가능할 것으로 내다봤다. ODD 지정을 통해 약물의 가치를 끌어올린 뒤엔 기술수출을 적극적으로 타진한단 계획이다. 최근 c-MET 표적 치료제에 대한 빅파마의 관심이 증가하고 있는 데 따라 기회가 많을 것이란 게 회사 측의 설명이다.
로슈가 올해 첫 기술도입 물질로 선택한 중국 바이오 기업 메디링크의 고형암 치료제 후보물질 ‘YL211’ 역시 c-MET을 타깃한다. 계약 규모가 총 10억달러(약 1조3000억원)에 달하는 대규모 딜이다. 다만 YL211는 항체약물접합체(ADC) 기전이라는 점에서 바바메킵과 차이가 있다.
에이비온 관계자는 “미국 ODD 신청을 통해 바바메킵의 시장 가치를 끌어올리고 임상에 속도를 내겠다”며 “임상 2상 중간 결과 발표 후 글로벌 제약사로부터 깊이 있는 협력 제안들을 받고 있다”고 말했다.



